Les vaccins contre le Covid-19 se sont avérés efficaces pour réduire la gravité de la maladie et la transmission de l’infection. La vaccination s’est toutefois vue rapidement confrontée à de nombreux défis, soulignant la nécessité de la découverte et de la conception de médicaments antiviraux susceptibles de renforcer l’arsenal thérapeutique contre le Covid-19.
Le 11 mars 2020 constitue un tournant pour l’humanité en matière de santé publique. En cette date, le directeur général de l’Organisation mondiale de la santé (OMS), Tedros Adhanom Ghebreyesus, a annoncé que le Covid-19 pouvait bel et bien être qualifié de pandémie. L’humanité s’est ainsi retrouvée à l’aube d’une nouvelle ère qui place la santé au cœur de l’avenir commun. Malgré les mesures sanitaires et policières draconiennes imposées par les gouvernements du monde entier pour endiguer la propagation du SARS-CoV-2, le Centre pour la science des systèmes et l’ingénierie de l’université Johns Hopkins à Baltimore, aux États-Unis, dénombrait, au 15 août 2022, 591.312.406 cas confirmés de Covid-19 et 6.438.307 morts dans le monde, dont 1.197.866 cas et 10.581 décès au Liban.
Le développement rapide et la production à grande échelle de vaccins à acide ribonucléique messager (ou ARNm) ont été cruciaux dans la lutte contre les vagues épidémiques ravageuses de Covid-19. Cependant, des difficultés d’accès à ces vaccins subsistent, comme le souligne l’Agence des Nations unies pour les réfugiés, des infections de percée (c’est-à-dire des infections contractées malgré un schéma complet de vaccination et un système immunitaire performant) se produisent et l’accumulation en crescendo de mutations par le virus donne naissance à des variants émergents, parfois dits préoccupants. Autant de facteurs qui pourraient constituer un risque accru de réinfection et donc d’éventuelles contractions de formes graves de la maladie.
Le développement de thérapies antivirales s’est donc rapidement imposé comme une nécessité pragmatique, voire une priorité absolue pour le traitement du nombre croissant de patients. Aussi plusieurs protéines codées par le SARS-CoV-2 ont-elles été identifiées comme des cibles moléculaires prometteuses en raison de leurs rôles essentiels dans le cycle de vie viral. En effet, l’entrée du virus est médiée par la liaison de la protéine de pointe virale, dite «Spike» ou S, à un récepteur, nommé ACE2, présent à la surface des cellules de l’hôte, notamment au niveau des poumons, mais également au niveau du cœur, du tractus digestif, des reins, des vaisseaux et de la sphère ORL.
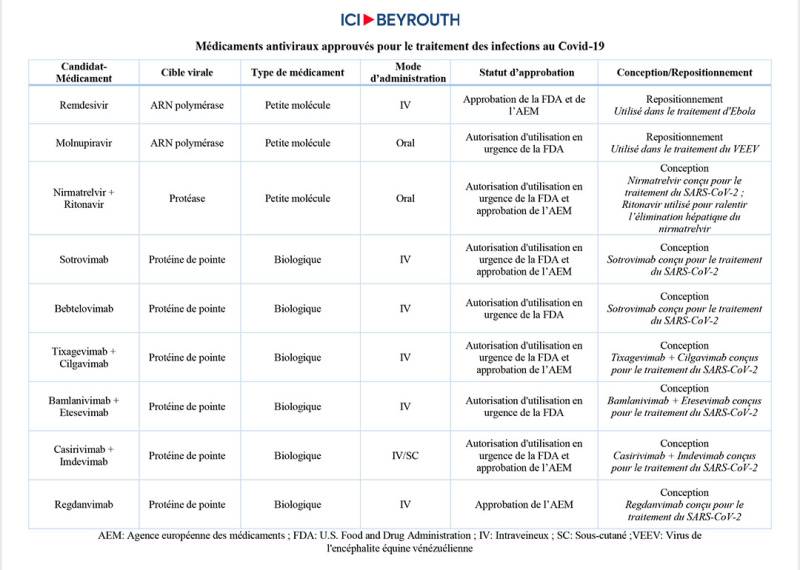
L’expression ubiquitaire dudit récepteur expliquerait la diversité des symptômes répertoriés chez les patients. Une fois que le coronavirus est à l’intérieur de la cellule, une panoplie d’enzymes participe à sa réplication. Au nombre desquelles deux protéases, enzymes nécessaires pour le clivage des protéines qui participent à la synthèse de nouvelles particules virales, et l’ARN polymérase, une enzyme centrale dans le processus de la transcription virale. Ainsi, la protéine S, certaines protéases et l’ARN polymérase représentent des cibles de prédilection pour la conception et le développement de médicaments antiviraux contre le SARS-CoV-2. D’ailleurs, les antiviraux ayant déjà reçu l’approbation formelle ou l’autorisation d’utilisation en urgence de l’Agence fédérale américaine des produits alimentaires et médicamenteux (FDA, acronyme de l’anglais pour Food and Drug Administration), pour le traitement du Covid-19, sont des inhibiteurs ciblant ces protéines virales.
Durant les deux dernières années, de nombreuses avancées sur le front des traitements antiviraux sont venues renforcer l’arsenal thérapeutique disponible face au Covid-19. Différentes stratégies ont ainsi été déployées sur le front scientifique dans la découverte de molécules antivirales contre le Covid-19, telles que la réaffectation de molécules thérapeutiques déjà approuvées ou en cours d’expérimentation au-delà de leurs indications d’origine, le criblage à haut débit des molécules candidates visant à accélérer la découverte de futurs médicaments, le criblage virtuel dit in silico (c’est-à-dire effectué au moyen d’ordinateurs) permettant de prédire des propriétés essentielles (physicochimiques ou biologiques) de librairies de molécules et la découverte de médicaments basée sur la structure biochimique. Au début de la pandémie, le repositionnement des médicaments, consistant à tester une molécule pharmaceutique pour une pathologie différente de celle pour laquelle elle avait été développée initialement, a suscité un grand intérêt chez les chercheurs, misant sur l’identification rapide de médicaments déjà approuvés pour d’autres indications et qui seraient potentiellement efficaces contre le Covid-19.
Le remdésivir, initialement développé pour le traitement de l’infection au virus Ebola, a été la première molécule susceptible d’être active contre le SARS-CoV-2. En effet, les données issues d’un essai clinique effectué sur 1.062 patients (541 patients ayant reçu le remdésivir et 521 patients le placebo) et publiées en mai 2020 par Beigel et al. dans The New England Journal of Medicine (NEJM) ont démontré une efficacité supérieure du remdésivir par rapport au placebo en termes de temps de récupération chez des adultes hospitalisés, positifs au Covid-19, et présentant des signes d’infection des voies respiratoires inférieures. Toutefois, ce bilan était loin de faire l’unanimité: les résultats d’un autre essai, intitulé Solidarity, publié en décembre 2020 dans NEJM, venaient contredire ceux du premier rapport. L’OMS, qui s’était montrée favorable en juin 2020 à l’utilisation du remdésivir, avait ainsi suggéré de ne plus l’utiliser, étant donné que ladite molécule «n’a aucun effet important sur la mortalité, le besoin de ventilation mécanique, le délai d’amélioration clinique et d’autres résultats importants pour le patient».
À la suite de la publication de nouvelles données, en janvier 2022 par Gottlieb et al. dans NEJM, l’OMS a mis à jour sa recommandation, suggérant désormais l’utilisation du remdésivir chez les patients adultes atteints de Covid-19 léger ou modéré et qui présentent un risque élevé d’hospitalisation. L’étude a été menée sur 562 patients non hospitalisés (279 patients ayant reçu le remdésivir et 283 patients le placebo) présentant au moins un facteur de risque de progression de la maladie (âge supérieur à 60 ans, obésité, ou certaines conditions médicales coexistantes).
C’est ainsi que le remdésivir est devenu le premier médicament à recevoir l’autorisation de mise sur le marché aussi bien aux États-Unis par la FDA qu’en Europe par l’Agence européenne des médicaments (AEM) pour le traitement des malades hospitalisés du Covid-19. Parallèlement, le 1ᵉʳ octobre 2021, il a été annoncé que le molnupiravir, un médicament initialement conçu pour le traitement des infections causées par le virus de l’encéphalite équine vénézuélienne (VEEV), peut réduire considérablement le risque d’hospitalisation ou de décès chez les patients atteints de Covid-19 léger ou modéré.
L’analyse intermédiaire d’un essai clinique randomisé et multicentrique (effectué dans plusieurs centres) de phase III, avait montré que seuls 7,3% des malades du groupe molnupiravir ont été hospitalisés ou sont décédés dans les 29 jours suivant le début du traitement, contre 14,1% de ceux du groupe placebo. Intitulé MOVe-OUT, cet essai a porté sur 775 patients positifs au Covid-19 et présentant un ou plusieurs facteurs de risque de progression de la maladie. Bernal et al. ont ainsi conclu que le molnupiravir pouvait réduire le taux de mortalité ou d’hospitalisation d’environ 50%.
Le 4 novembre 2021, le molnupiravir a été approuvé par l’Agence britannique de réglementation des médicaments et des produits de santé (MHRA, acronyme de l’anglais pour UK Medicines and Healthcare products Regulatory Agency) pour le traitement des patients atteints d’une forme légère à modérée de Covid-19. Il devient ainsi le premier médicament oral à figurer dans les directives de traitement du Covid-19. Quelques semaines plus tard, le 23 décembre 2021, c’est au tour de la FDA d’accorder une autorisation d’utilisation d’urgence pour le molnupiravir pour le traitement des adultes à haut risque atteints d’une forme légère à modérée de la maladie.
Outre la réaffectation des médicaments, de nouvelles molécules, notamment un certain nombre d’anticorps monoclonaux neutralisants ciblant la protéine de pointe virale S et un inhibiteur spécifique de protéase, ont également été découvertes, développées et approuvées par les autorités chargées de la réglementation des médicaments aux États-Unis, en Europe ou ailleurs, en tant que traitements anti-Covid-19. Cette partie fera l’objet d’un article distinct sur Ici Beyrouth.
Le 11 mars 2020 constitue un tournant pour l’humanité en matière de santé publique. En cette date, le directeur général de l’Organisation mondiale de la santé (OMS), Tedros Adhanom Ghebreyesus, a annoncé que le Covid-19 pouvait bel et bien être qualifié de pandémie. L’humanité s’est ainsi retrouvée à l’aube d’une nouvelle ère qui place la santé au cœur de l’avenir commun. Malgré les mesures sanitaires et policières draconiennes imposées par les gouvernements du monde entier pour endiguer la propagation du SARS-CoV-2, le Centre pour la science des systèmes et l’ingénierie de l’université Johns Hopkins à Baltimore, aux États-Unis, dénombrait, au 15 août 2022, 591.312.406 cas confirmés de Covid-19 et 6.438.307 morts dans le monde, dont 1.197.866 cas et 10.581 décès au Liban.
Le développement rapide et la production à grande échelle de vaccins à acide ribonucléique messager (ou ARNm) ont été cruciaux dans la lutte contre les vagues épidémiques ravageuses de Covid-19. Cependant, des difficultés d’accès à ces vaccins subsistent, comme le souligne l’Agence des Nations unies pour les réfugiés, des infections de percée (c’est-à-dire des infections contractées malgré un schéma complet de vaccination et un système immunitaire performant) se produisent et l’accumulation en crescendo de mutations par le virus donne naissance à des variants émergents, parfois dits préoccupants. Autant de facteurs qui pourraient constituer un risque accru de réinfection et donc d’éventuelles contractions de formes graves de la maladie.
Priorité absolue
Le développement de thérapies antivirales s’est donc rapidement imposé comme une nécessité pragmatique, voire une priorité absolue pour le traitement du nombre croissant de patients. Aussi plusieurs protéines codées par le SARS-CoV-2 ont-elles été identifiées comme des cibles moléculaires prometteuses en raison de leurs rôles essentiels dans le cycle de vie viral. En effet, l’entrée du virus est médiée par la liaison de la protéine de pointe virale, dite «Spike» ou S, à un récepteur, nommé ACE2, présent à la surface des cellules de l’hôte, notamment au niveau des poumons, mais également au niveau du cœur, du tractus digestif, des reins, des vaisseaux et de la sphère ORL.
L’expression ubiquitaire dudit récepteur expliquerait la diversité des symptômes répertoriés chez les patients. Une fois que le coronavirus est à l’intérieur de la cellule, une panoplie d’enzymes participe à sa réplication. Au nombre desquelles deux protéases, enzymes nécessaires pour le clivage des protéines qui participent à la synthèse de nouvelles particules virales, et l’ARN polymérase, une enzyme centrale dans le processus de la transcription virale. Ainsi, la protéine S, certaines protéases et l’ARN polymérase représentent des cibles de prédilection pour la conception et le développement de médicaments antiviraux contre le SARS-CoV-2. D’ailleurs, les antiviraux ayant déjà reçu l’approbation formelle ou l’autorisation d’utilisation en urgence de l’Agence fédérale américaine des produits alimentaires et médicamenteux (FDA, acronyme de l’anglais pour Food and Drug Administration), pour le traitement du Covid-19, sont des inhibiteurs ciblant ces protéines virales.
Arsenal thérapeutique
Durant les deux dernières années, de nombreuses avancées sur le front des traitements antiviraux sont venues renforcer l’arsenal thérapeutique disponible face au Covid-19. Différentes stratégies ont ainsi été déployées sur le front scientifique dans la découverte de molécules antivirales contre le Covid-19, telles que la réaffectation de molécules thérapeutiques déjà approuvées ou en cours d’expérimentation au-delà de leurs indications d’origine, le criblage à haut débit des molécules candidates visant à accélérer la découverte de futurs médicaments, le criblage virtuel dit in silico (c’est-à-dire effectué au moyen d’ordinateurs) permettant de prédire des propriétés essentielles (physicochimiques ou biologiques) de librairies de molécules et la découverte de médicaments basée sur la structure biochimique. Au début de la pandémie, le repositionnement des médicaments, consistant à tester une molécule pharmaceutique pour une pathologie différente de celle pour laquelle elle avait été développée initialement, a suscité un grand intérêt chez les chercheurs, misant sur l’identification rapide de médicaments déjà approuvés pour d’autres indications et qui seraient potentiellement efficaces contre le Covid-19.
Eurêka!
Le remdésivir, initialement développé pour le traitement de l’infection au virus Ebola, a été la première molécule susceptible d’être active contre le SARS-CoV-2. En effet, les données issues d’un essai clinique effectué sur 1.062 patients (541 patients ayant reçu le remdésivir et 521 patients le placebo) et publiées en mai 2020 par Beigel et al. dans The New England Journal of Medicine (NEJM) ont démontré une efficacité supérieure du remdésivir par rapport au placebo en termes de temps de récupération chez des adultes hospitalisés, positifs au Covid-19, et présentant des signes d’infection des voies respiratoires inférieures. Toutefois, ce bilan était loin de faire l’unanimité: les résultats d’un autre essai, intitulé Solidarity, publié en décembre 2020 dans NEJM, venaient contredire ceux du premier rapport. L’OMS, qui s’était montrée favorable en juin 2020 à l’utilisation du remdésivir, avait ainsi suggéré de ne plus l’utiliser, étant donné que ladite molécule «n’a aucun effet important sur la mortalité, le besoin de ventilation mécanique, le délai d’amélioration clinique et d’autres résultats importants pour le patient».
Premières autorisations
À la suite de la publication de nouvelles données, en janvier 2022 par Gottlieb et al. dans NEJM, l’OMS a mis à jour sa recommandation, suggérant désormais l’utilisation du remdésivir chez les patients adultes atteints de Covid-19 léger ou modéré et qui présentent un risque élevé d’hospitalisation. L’étude a été menée sur 562 patients non hospitalisés (279 patients ayant reçu le remdésivir et 283 patients le placebo) présentant au moins un facteur de risque de progression de la maladie (âge supérieur à 60 ans, obésité, ou certaines conditions médicales coexistantes).
C’est ainsi que le remdésivir est devenu le premier médicament à recevoir l’autorisation de mise sur le marché aussi bien aux États-Unis par la FDA qu’en Europe par l’Agence européenne des médicaments (AEM) pour le traitement des malades hospitalisés du Covid-19. Parallèlement, le 1ᵉʳ octobre 2021, il a été annoncé que le molnupiravir, un médicament initialement conçu pour le traitement des infections causées par le virus de l’encéphalite équine vénézuélienne (VEEV), peut réduire considérablement le risque d’hospitalisation ou de décès chez les patients atteints de Covid-19 léger ou modéré.
L’analyse intermédiaire d’un essai clinique randomisé et multicentrique (effectué dans plusieurs centres) de phase III, avait montré que seuls 7,3% des malades du groupe molnupiravir ont été hospitalisés ou sont décédés dans les 29 jours suivant le début du traitement, contre 14,1% de ceux du groupe placebo. Intitulé MOVe-OUT, cet essai a porté sur 775 patients positifs au Covid-19 et présentant un ou plusieurs facteurs de risque de progression de la maladie. Bernal et al. ont ainsi conclu que le molnupiravir pouvait réduire le taux de mortalité ou d’hospitalisation d’environ 50%.
Le 4 novembre 2021, le molnupiravir a été approuvé par l’Agence britannique de réglementation des médicaments et des produits de santé (MHRA, acronyme de l’anglais pour UK Medicines and Healthcare products Regulatory Agency) pour le traitement des patients atteints d’une forme légère à modérée de Covid-19. Il devient ainsi le premier médicament oral à figurer dans les directives de traitement du Covid-19. Quelques semaines plus tard, le 23 décembre 2021, c’est au tour de la FDA d’accorder une autorisation d’utilisation d’urgence pour le molnupiravir pour le traitement des adultes à haut risque atteints d’une forme légère à modérée de la maladie.
Outre la réaffectation des médicaments, de nouvelles molécules, notamment un certain nombre d’anticorps monoclonaux neutralisants ciblant la protéine de pointe virale S et un inhibiteur spécifique de protéase, ont également été découvertes, développées et approuvées par les autorités chargées de la réglementation des médicaments aux États-Unis, en Europe ou ailleurs, en tant que traitements anti-Covid-19. Cette partie fera l’objet d’un article distinct sur Ici Beyrouth.
Lire aussi


Commentaires