
Selon une étude parue en juillet dernier dans Science Advances, le SARS-CoV-2 emprunterait des «tunnels» nanoscopiques, appelés nanotubes, présents au niveau des cellules olfactives, pour accéder au cerveau et infecter les neurones.
Les patients atteints de Covid-19 présentent une myriade de symptômes neurologiques, suggérant que le SARS-CoV-2, le virus responsable de la maladie, pourrait, à l’instar d’autres virus (comme le cytomégalovirus, le virus de l’herpès simplex, et le poliovirus, entre autres), envahir et infecter le système nerveux central (SNC). En effet, bien que le SARS-CoV-2 cible principalement les voies respiratoires, d’autres organes tels que l’intestin, le foie, les reins, le cœur et le cerveau peuvent également être affectés. Les résultats d’une étude post-mortem, effectuée par l’équipe du professeur Markus Glatzel de l’Institute of Neuropathology à Hambourg, en Allemagne, sur le cerveau de 43 patients décédés et positifs au Covid-19, publiés dans The Lancet Neurology, ont permis de mettre en évidence la présence dudit virus au niveau du SNC: l’acide ribonucléique (ARN) ou des protéines virales, relatifs au SARS-CoV-2, ont été détectés respectivement par PCR ou immunomarquage (une méthode de biologie moléculaire permettant la localisation d’une protéine donnée sur une coupe de tissu via l’utilisation d’un anticorps spécifique à la protéine recherchée), dans le cerveau de 21 de 40 patients testés (soit 53% de l’échantillon étudié). Dans une autre étude, dirigée par le professeur Frank Heppner et publiée dans Nature Neuroscience en novembre 2020, les auteurs estiment que la présence de particules et d’ARN viraux du SARS-CoV-2 au niveau de la muqueuse olfactive, mais également dans des zones cérébrales relatives à l’olfaction, pourrait être une preuve tangible que les cellules olfactives constituent la voie d’entrée du virus vers le cerveau. Une telle découverte soulève toutefois une question primordiale: comment le coronavirus, qui pénètre dans l’organisme par les voies respiratoires supérieures (notamment le nez), parvient-il à migrer jusqu’au cerveau?
Afin d’élucider cette problématique, des chercheurs de l’Institut Pasteur, en France, ont mené une série d’expériences in vitro (c’est-à-dire des travaux de recherche conduits au laboratoire en dehors d’un organisme vivant) sur des cellules neuronales, mais également sur des cellules de reins de singe (couramment utilisées pour modéliser les voies respiratoires humaines dans les études sur le Covid-19). Ils ont, tout d’abord, testé différentes lignées de cellules neuronales, humaines et murines (c’est-à-dire relatives à la souris), pour étudier leur permissivité à l’infection virale. Ces lignées ont ainsi été mises en culture avec le SARS-CoV-2. Trois jours plus tard, aucune de ces dernières n’a montré de signe d’infection ou de production virale, par opposition aux cellules témoins qui, elles, étaient sensibles à l’infection par le coronavirus. Ces données montrent que les cellules neuronales ne peuvent pas être infectées directement par le virus, comme c’est le cas des cellules pulmonaires. En fait, l’entrée du virus, dans ces dernières, est assurée par la liaison de la protéine de pointe virale, dite «Spike» ou S, à un récepteur, nommé ACE2, présent à la surface des cellules de l’hôte, notamment au niveau des poumons (voir la figure ci-dessous). Cependant, ce qui est vrai pour les cellules pulmonaires ne l’est pas pour les cellules cérébrales: aucun signal cellulaire impliquant le récepteur ACE2 n’a pu être mis en évidence, confirmant, de ce fait, les observations précédentes faisant état de niveaux d’expression extrêmement faibles de ce récepteur dans les cellules neuronales.
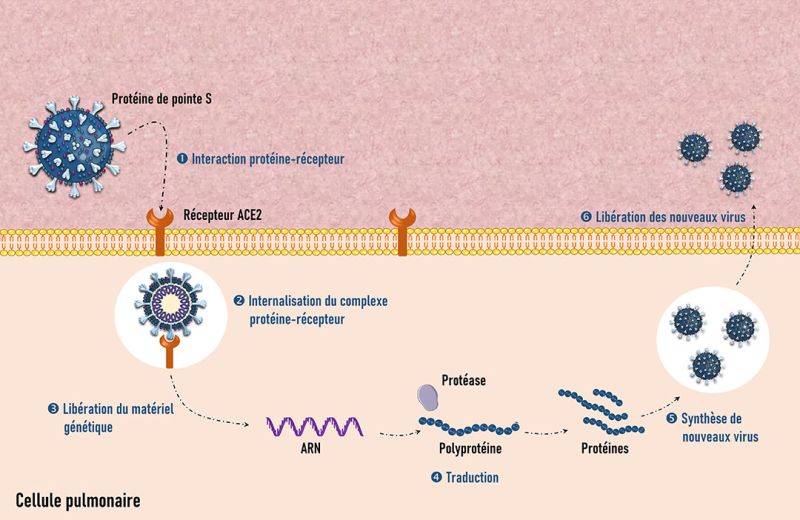 Représentation de l’entrée du SARS-CoV-2 dans une cellule pulmonaire
Représentation de l’entrée du SARS-CoV-2 dans une cellule pulmonaire
Écartant cette première hypothèse, les chercheurs de l’Institut Pasteur ont testé une autre voie d’accès qui pourrait permettre au SARS-CoV-2 de pénétrer dans les cellules neuronales, celle des voies de communication intercellulaires. Afin de tester cette nouvelle hypothèse, les auteurs de cette étude ont mis en contact le coronavirus avec des cellules modélisées en culture: des cellules de reins de singe, dites permissives à l’infection par le coronavirus (c’est-à-dire qui peuvent être infectées par ce virus), et des cellules neuronales humaines non permissives à cette infection. Après, les cellules ont été fixées et colorées dans le but de mettre en évidence la présence ou pas d’infection. À l’aide d’un microscope à fluorescence et d’un logiciel informatique, le pourcentage de cellules neuronales infectées a été calculé: après 24 heures de coculture, 36,4% des cellules contenaient des zones colorées dans leur cytoplasme, démontrant la présence du SARS-CoV-2; ce pourcentage est ensuite passé à 62,5% après 48 heures. Ces observations fournissent la preuve que la propagation du virus entre les cellules permissives et les cellules neuronales non permissives pourrait se produire par un contact direct de cellule à cellule.
Bien que suggestive, la résolution limitée de la microscopie à fluorescence ne permettait pas de fournir des informations définitives sur la nature et la structure des particules virales transmises d’une cellule à une autre, ainsi que sur le mode de transmission. Afin de surmonter ces limites, les chercheurs ont eu recours à un microscope électronique, permettant de révéler l’architecture du SARS-CoV-2 mais également des tunnels intercellulaires, nommés nanotubes, dans les conditions les plus réelles. Cela a permis à l’équipe de l’Institut Pasteur de montrer que le coronavirus induit la formation de nanotubes à effet tunnel et exploite cette voie pour se propager aux cellules non infectées. De plus, d’autres résultats indiquent que l’infection par le SARS-CoV-2 a entraîné une augmentation du pourcentage de cellules connectées à travers les nanotubes. Ces données mettent en évidence un mécanisme jusque-là inconnu de propagation dudit virus, probablement utilisé comme moyen pour envahir les cellules non permissives et potentialiser l’infection dans les cellules permissives. Une fois niché dans les cellules neuronales, le coronavirus a pu continuer à se répliquer normalement.
Ces résultats encourageants fraient le chemin à de nouvelles investigations sur le rôle de la communication intercellulaire dans la migration du coronavirus au cerveau dans des contextes plus physiologiques, notamment le rôle potentiel des nanotubes dans la propagation du virus à partir de la muqueuse de la cavité nasale aux neurones sensoriels olfactifs dans le SNC. Ce travail de recherche pourrait également contribuer à l’élucidation des mécanismes à l’œuvre dans l’apparition du Covid long et des approches thérapeutiques alternatives pour altérer la diffusion virale en plus des recherches actuelles principalement axées sur le blocage de l’interaction entre la protéine S et le récepteur ACE2.
Les patients atteints de Covid-19 présentent une myriade de symptômes neurologiques, suggérant que le SARS-CoV-2, le virus responsable de la maladie, pourrait, à l’instar d’autres virus (comme le cytomégalovirus, le virus de l’herpès simplex, et le poliovirus, entre autres), envahir et infecter le système nerveux central (SNC). En effet, bien que le SARS-CoV-2 cible principalement les voies respiratoires, d’autres organes tels que l’intestin, le foie, les reins, le cœur et le cerveau peuvent également être affectés. Les résultats d’une étude post-mortem, effectuée par l’équipe du professeur Markus Glatzel de l’Institute of Neuropathology à Hambourg, en Allemagne, sur le cerveau de 43 patients décédés et positifs au Covid-19, publiés dans The Lancet Neurology, ont permis de mettre en évidence la présence dudit virus au niveau du SNC: l’acide ribonucléique (ARN) ou des protéines virales, relatifs au SARS-CoV-2, ont été détectés respectivement par PCR ou immunomarquage (une méthode de biologie moléculaire permettant la localisation d’une protéine donnée sur une coupe de tissu via l’utilisation d’un anticorps spécifique à la protéine recherchée), dans le cerveau de 21 de 40 patients testés (soit 53% de l’échantillon étudié). Dans une autre étude, dirigée par le professeur Frank Heppner et publiée dans Nature Neuroscience en novembre 2020, les auteurs estiment que la présence de particules et d’ARN viraux du SARS-CoV-2 au niveau de la muqueuse olfactive, mais également dans des zones cérébrales relatives à l’olfaction, pourrait être une preuve tangible que les cellules olfactives constituent la voie d’entrée du virus vers le cerveau. Une telle découverte soulève toutefois une question primordiale: comment le coronavirus, qui pénètre dans l’organisme par les voies respiratoires supérieures (notamment le nez), parvient-il à migrer jusqu’au cerveau?
Permissivité à l’infection virale
Afin d’élucider cette problématique, des chercheurs de l’Institut Pasteur, en France, ont mené une série d’expériences in vitro (c’est-à-dire des travaux de recherche conduits au laboratoire en dehors d’un organisme vivant) sur des cellules neuronales, mais également sur des cellules de reins de singe (couramment utilisées pour modéliser les voies respiratoires humaines dans les études sur le Covid-19). Ils ont, tout d’abord, testé différentes lignées de cellules neuronales, humaines et murines (c’est-à-dire relatives à la souris), pour étudier leur permissivité à l’infection virale. Ces lignées ont ainsi été mises en culture avec le SARS-CoV-2. Trois jours plus tard, aucune de ces dernières n’a montré de signe d’infection ou de production virale, par opposition aux cellules témoins qui, elles, étaient sensibles à l’infection par le coronavirus. Ces données montrent que les cellules neuronales ne peuvent pas être infectées directement par le virus, comme c’est le cas des cellules pulmonaires. En fait, l’entrée du virus, dans ces dernières, est assurée par la liaison de la protéine de pointe virale, dite «Spike» ou S, à un récepteur, nommé ACE2, présent à la surface des cellules de l’hôte, notamment au niveau des poumons (voir la figure ci-dessous). Cependant, ce qui est vrai pour les cellules pulmonaires ne l’est pas pour les cellules cérébrales: aucun signal cellulaire impliquant le récepteur ACE2 n’a pu être mis en évidence, confirmant, de ce fait, les observations précédentes faisant état de niveaux d’expression extrêmement faibles de ce récepteur dans les cellules neuronales.
 Représentation de l’entrée du SARS-CoV-2 dans une cellule pulmonaire
Représentation de l’entrée du SARS-CoV-2 dans une cellule pulmonaireVoies de communication intercellulaires
Écartant cette première hypothèse, les chercheurs de l’Institut Pasteur ont testé une autre voie d’accès qui pourrait permettre au SARS-CoV-2 de pénétrer dans les cellules neuronales, celle des voies de communication intercellulaires. Afin de tester cette nouvelle hypothèse, les auteurs de cette étude ont mis en contact le coronavirus avec des cellules modélisées en culture: des cellules de reins de singe, dites permissives à l’infection par le coronavirus (c’est-à-dire qui peuvent être infectées par ce virus), et des cellules neuronales humaines non permissives à cette infection. Après, les cellules ont été fixées et colorées dans le but de mettre en évidence la présence ou pas d’infection. À l’aide d’un microscope à fluorescence et d’un logiciel informatique, le pourcentage de cellules neuronales infectées a été calculé: après 24 heures de coculture, 36,4% des cellules contenaient des zones colorées dans leur cytoplasme, démontrant la présence du SARS-CoV-2; ce pourcentage est ensuite passé à 62,5% après 48 heures. Ces observations fournissent la preuve que la propagation du virus entre les cellules permissives et les cellules neuronales non permissives pourrait se produire par un contact direct de cellule à cellule.
Des tunnels intercellulaires
Bien que suggestive, la résolution limitée de la microscopie à fluorescence ne permettait pas de fournir des informations définitives sur la nature et la structure des particules virales transmises d’une cellule à une autre, ainsi que sur le mode de transmission. Afin de surmonter ces limites, les chercheurs ont eu recours à un microscope électronique, permettant de révéler l’architecture du SARS-CoV-2 mais également des tunnels intercellulaires, nommés nanotubes, dans les conditions les plus réelles. Cela a permis à l’équipe de l’Institut Pasteur de montrer que le coronavirus induit la formation de nanotubes à effet tunnel et exploite cette voie pour se propager aux cellules non infectées. De plus, d’autres résultats indiquent que l’infection par le SARS-CoV-2 a entraîné une augmentation du pourcentage de cellules connectées à travers les nanotubes. Ces données mettent en évidence un mécanisme jusque-là inconnu de propagation dudit virus, probablement utilisé comme moyen pour envahir les cellules non permissives et potentialiser l’infection dans les cellules permissives. Une fois niché dans les cellules neuronales, le coronavirus a pu continuer à se répliquer normalement.
Ces résultats encourageants fraient le chemin à de nouvelles investigations sur le rôle de la communication intercellulaire dans la migration du coronavirus au cerveau dans des contextes plus physiologiques, notamment le rôle potentiel des nanotubes dans la propagation du virus à partir de la muqueuse de la cavité nasale aux neurones sensoriels olfactifs dans le SNC. Ce travail de recherche pourrait également contribuer à l’élucidation des mécanismes à l’œuvre dans l’apparition du Covid long et des approches thérapeutiques alternatives pour altérer la diffusion virale en plus des recherches actuelles principalement axées sur le blocage de l’interaction entre la protéine S et le récepteur ACE2.
Lire aussi



Commentaires